Elektrofile i nukleofile
Electrophile i Nucleophile to dwie ważne koncepcje w chemii organicznej, które pomagają opisać reakcje chemiczne między akceptorami elektronów i dawcami. Te dwa pojęcia zostały wprowadzone w 1933 roku przez Christophera Kelka Ingolda i służyły jako zamienniki terminów kationoidalnych i anioidalnych, które zostały wprowadzone w 1925 roku przez A.J. Lapworth.
Od tego czasu przeprowadzono szeroko zakrojone badania, aby zrozumieć różnice między elektrofilem i nukleofilem. W tym artykule wyjaśniono różnicę między tymi dwoma koncepcjami. W skrócie, nukleofil jest donorem elektronów, podczas gdy elektrofil jest akceptorem elektronów.
Czym jest elektrofil?
Aby przerwać ten termin, słowo "electro" pochodzi od elektronów, a łacińskie słowo "phile" odnosi się do "miłości". Mówiąc najprościej, oznacza to kochanie elektronów. Jest to odczynnik, który charakteryzuje się niską gęstością elektronów w powłoce falistej, a zatem reaguje z cząsteczką, jonem lub atomem o wysokiej gęstości, tworząc wiązanie kowalencyjne. Przykładem substancji elektrofilowych jest jon wodorowy w kwasach i metylokarboksylacja. Są niedobór elektronów.
Elektrofil jest łatwo wykrywany przez ładunek dodatni lub ładunek obojętny z pustymi orbitami (niespełniającymi zasady oktetu). Elektrony przemieszczają się z obszaru o dużej gęstości do obszaru o niskiej gęstości, w przeciwieństwie do ładunków przyciągają się nawzajem. Ta teoria wyjaśnia przyciąganie elektronów przez pozbawione elektronów elektrofilowe atomy, cząsteczki lub jony. Z definicji, elektrofil jest zamiennie nazywany kwasem Lewisa, ponieważ przyjmuje on elektrony zgodnie z definicją kwasu.
Reakcja i związki poniżej pokazują przykłady elektrofilów:

W tej reakcji jon wodorotlenowy reaguje z chlorowodorem; w ten sposób kwas reaguje z zasadą. Jak wskazuje strzałka, bardziej elektroujemny atom tlenu przekazuje elektrony atomowi elektronowemu z niedoborem elektronów. Dzieli on samotną parę z atomem wodoru, który ma dodatni ładunek w chlorowodorze związku, ponieważ jest bardziej elektroujemny niż wodór. Ta reakcja jest podstawą wielu reakcji chemii organicznej, szczególnie reakcji zasad kwasu Lewisa i Lewisa. Inne przykłady są przedstawione na poniższym obrazku:
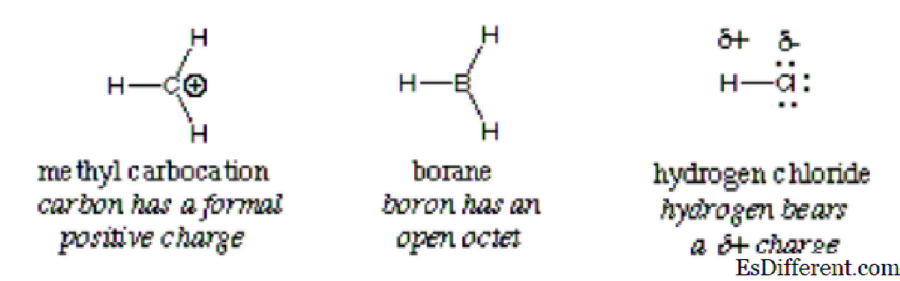
Ogólnie rzecz biorąc, elektrofil jest identyfikowany przez częściowy ładunek dodatni, jak w chlorowodorze, formalny ładunek dodatni, jak w przypadku karboksylacji metylowej lub wolnych orbitali. Spolaryzowane obojętne cząsteczki, takie jak halogenki acylowe, związki karbonylowe i halogenki alkilowe są typowymi przykładami elektrofilów.
Ważny: Jon hydroniowy, chociaż ma ładunek dodatni, nie kwalifikuje się do sklasyfikowania jako elektrofil z powodu wolnych orbitali w swojej zewnętrznej powłoce. Daje jon wodorowy i wodę. To samo dotyczy jonu amonowego; nie ma wolnych orbitali, które mogą przyciągać elektrony. W rezultacie nie jest elektrofilem.
Co to jest nukleofil?
Termin ten jest podzielony na słowo "nucleo", które odnosi się do jądra i łacińskiego słowa "phile", które oznacza kochanie. To po prostu oznacza kochanie jądra. Nukleofile są bogate w elektrony i w ten sposób przekazują pary elektronów do elektrofilów, tworząc wiązania kowalencyjne w reakcjach chemicznych. Substancje te są najlepiej widoczne w przypadku par wolnych, wiązań pi i ładunków ujemnych. Amoniak, jony jodkowe i wodorotlenowe są przykładami substancji nukleofilnych.
Z definicji nukleofil jest wymiennie nazywany podstawą Lewisa, ponieważ wszystkie one przekazują elektrony i akceptują protony. Poniższy rysunek przedstawia przykłady nukleofili:

Środek nukleofilowy w związku jest wykrywany za pomocą najbardziej elektroujemnego atomu. Rozważ amoniak NH3; azot jest bardziej elektroujemny i w ten sposób przyciąga elektrony do centrum. Związek ma wysoką gęstość elektronową i, gdy reaguje z elektrofilem, np. Wodą, przekazuje elektrony. H2O może działać zarówno jako elektrofil, jak i nukleofil w zależności od związku lub cząsteczki, z którą reaguje.
Rozważ poniższe zdjęcie:
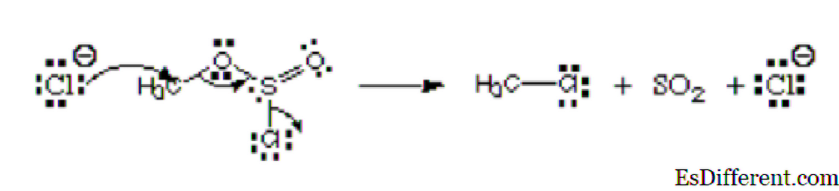
Na zdjęciu, pierwszy atom, jon chlorkowy przekazuje swoją wolną parę do węgla, tworząc wiązanie kowalencyjne. Ma ładunek ujemny i przekazuje elektrony, dlatego jest uważany za nukleofil. Ten atom chloru, który opuszcza ester chlorosiarczynu, nazywa się grupą opuszczającą. To nie jest elektrofilem ani nukleofilem.
Kluczowa różnica między elektrofilem i nukleofilem
Definicja elektrofilu i nukleofilu
Elektrofil jest kwasem Lewisa, który przyjmuje elektrony z atomu, jonu lub cząsteczki bogatej w elektrony. Akceptując elektrony, tworzy wiązanie kowalencyjne. Odczynnik ten jest często identyfikowany przez częściowy ładunek dodatni, formalny ładunek dodatni lub neutralny atom, jon lub cząsteczkę, która nie spełnia zasady oktetu. Z drugiej strony nukleofil to atom, jon lub cząsteczka o dużej gęstości elektronów. To oddaje samotną parę do elektrofilu, tworząc wiązanie kowalencyjne. Jest identyfikowany przez ładunki dodatnie i wolne elektrony na swojej orbicie.
Reakcje chemiczne elektrofilów i nukleofilów
Nukleofil jest zaangażowany w substytucję nukleofilową i addycję, podczas gdy elektrofil jest zaangażowany w elektrofilowe podstawienie i addycję.
Charge Identity w electrophile i nukleofilu
Elektrofile mogą być naładowane neutralnie lub dodatnio, podczas gdy nukleofil może być naładowany neutralnie lub ujemnie.Elektrofile akceptują elektrony, dlatego nazywa się je kwasem Lewisa, podczas gdy nukleofil przekazuje elektrony, dlatego nazywa się je zasadą Lewisa.
Electrophile Verses Nucleophile: Tabela porównawcza

Podsumowanie wersetów elektrofilowych Nukleofil
- Elektrofil jest atomem jonowym lub cząsteczkowym pozbawionym elektronu, a nukleofil - atomem bogatym w elektrony, cząsteczką lub jonem
- Elektrofile mogą być naładowane dodatnio lub neutralnie, podczas gdy nukleofil może być naładowany ujemnie lub neutralnie
- Elektrofil nazywany jest kwasem Lewisa, a nukleofil nazywany jest zasadą Lewisa
- Elektrofile akceptują elektrony i przekazują protony, podczas gdy nukleofil przekazuje elektrony i przyjmuje protony.




